El grupo dedica su actividad científica a diversos aspectos de la química de carbohidratos y proteínas.
Desde un enfoque multidisciplinar que implica síntesis química, métodos de reconocimiento molecular (RMN, electroquímica, calorimetría, etc.) y biofísica se desarrollan proyectos sobre sensores moleculares y transportadores de fármacos, así como se investiga sobre los mecanismos de las interacciones no covalentes entre proteínas y moléculas bioactivas de interés terapéutico.
Las ciclodextrinas (CD) son oligosacáridos cíclicos que están formados por seis (α-CD), siete (β-CD) y ocho (γ-CD) unidades de D-glucopiranosa unidas por enlaces α-(1→4).
La β-CD posee una estructura relativamente rígida en forma de toroide, con una cavidad interna hidrófoba y con bordes de naturaleza hidrofílica.
Es bien conocida la capacidad de la β-CD para formar complejos de inclusión en solución acuosa con una gran variedad de moléculas orgánicas de naturaleza hidrofóbica y del tamaño y geometría adecuados para encajar en la cavidad.
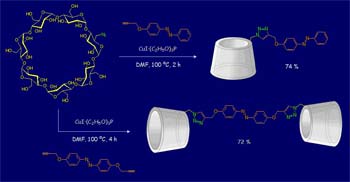
En nuestro laboratorio investigamos metodologías sintéticas que permiten la preparación de β-CD, bis(β-CD) y sistemas multi-β-CD funcionales.
Sensores basados en ciclodextrina
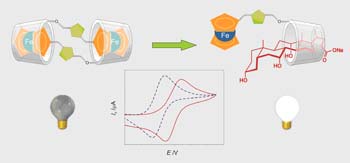
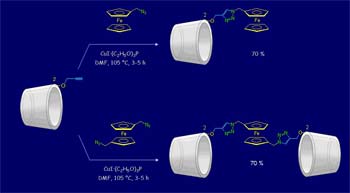
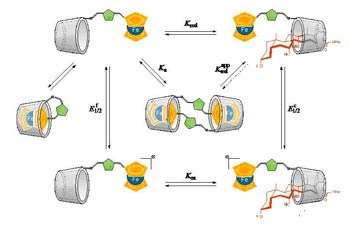
Debido al interés por construir sistemas sensores o interruptores redox de naturaleza molecular o supramolecular que puedan ser controlados mediante la aplicación de estímulos externos, la síntesis de compuestos conteniendo ferroceno y sitios de reconocimiento molecular ha sido foco de atención en los últimos años.
Sistemas de transporte molecular basados en ciclodextrina
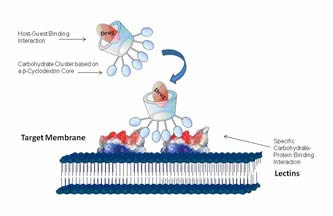
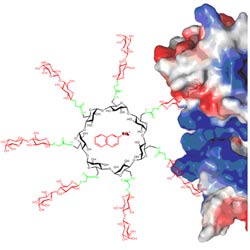
“Clusters” o clústeres de carbohidratos sobre plataformas moleculares sencillas, superficies, polímeros lineales o unidos a los grupos terminales de dendrímeros, son y han sido foco de atención de muchos investigadores de campos que van desde la síntesis a las aplicaciones biológicas y farmacéuticas. Este interés por los clústeres y dendrímeros de glicósidos se debe al intento de aplicar el llamado efecto clúster o multivalente glicosídico. De acuerdo con este efecto, agrupaciones de copias de ligandos carbohidratos -ligandos multivalentes- interaccionan con sus proteínas receptoras de una manera más fuerte y más selectiva que la suma de las interacciones de cada uno de los ligandos con sus receptores. Este fenómeno es ubicuo en la naturaleza y puede observarse en una gran variedad de importantes funciones biológicas. Si el glicoclúster tiene además la capacidad de encapsular moléculas huésped, particularmente fármacos, puede ser posible diseñar un sistema de transporte molecular que posibilite entregar el fármaco de una manera no covalente a un receptor biológico específico.
En nuestro laboratorio investigamos metodologías sintéticas que permiten la preparación de β-CD, bis(β-CD) y sistemas multi-β-CD funcionales.
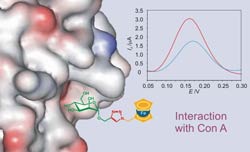
La unión covalente de grupos electroactivos con moléculas que contienen sitios de unión para reconocimiento molecular es una forma de construir interruptores y sensores redox controlables mediante estímulos externos. El metaloceno ferroceno cumple con los requisitos necesarios para convertirse en una buena pieza para la construcción de estos dispositivos moleculares: el ferroceno es muy sensible a una oxidación monoelectrónica controlable química y electroquímicamente, es estable en soluciones acuosas y en la mayoría de las condiciones de reacción aplicadas en síntesis. En nuestro laboratorio investigamos métodos para la síntesis de conjugados ferroceno-carbohidrato monovalentes y multivalentes y estudiamos la afinidad de estos por receptores modelo y las lectinas (Con A, PNA y galectinas). Las propiedades de reconocimiento molecular de estos neoglicoconjugados y su utilidad como sensores electroquímicos, las estudiamos utilizando métodos calorimétricos, resonancia magnética nuclear y métodos electroquímicos
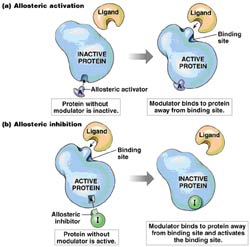
Otra parte importante del trabajo que desarrolla el grupo está basado en la aplicación de técnicas biofísicas para el conocimiento de la función de las proteínas a través de estudios de reconocimiento molecular con moléculas bioactivas (ligandos).
Uno de los objetivos de nuestra investigación está basado en incrementar el conocimiento sobre los factores termodinámicos implicados en las interacciones proteína-ligando. En el desarrollo de esta investigación se combinan técnicas biofísicas y biología molecular. La caracterización de una interacción intermolecular está basada en evaluar la especificidad y la fortaleza de la interacción. Por otro lado, se analiza la influencia de ciertas variables experimentales como pH, fuerza iónica, temperatura, etc..
Las interacciones intermoleculares se pueden analizar macroscópicamente (estudios termodinámicos y cinéticos) o a nivel de resolución atómica. Técnicas tales como RMN o cristalografía de rayos X, permiten medir parámetros atómicos individuales consiguiendo un nivel de resolución atómica y una descripción estructural de la interacción.
Una caracterización global de una reacción intermolecular implica la determinación de la estequiometría y el cambio de los potenciales termodinámicos entre el estado inicial y final: afinidad, energía de Gibbs, entalpía y entropía de unión.
Estas técnicas proporcionan, por tanto, una descripción energética de la interacción.
Adicionalmente, cambiando las variables experimentales (temperatura, pH, etc.) y modificando las moléculas interaccionantes, es posible obtener información sobre las interacciones atómicas determinantes en el proceso de unión (enlaces de hidrógeno, van der Waals, electrostáticas, etc.).
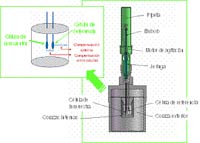
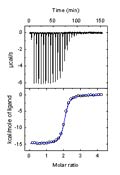
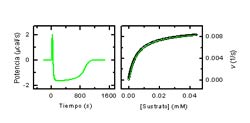
La calorimetría isotérmica de valoración (ITC) permite la determinación directa de la entalpía de unión sin necesidad de modelos o hipótesis adicionales.
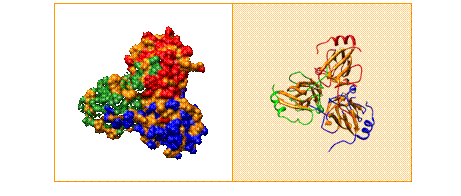
La calorimetría diferencial de barrido (DSC) es una técnica muy apropiada para estudiar la estabilidad térmica de proteínas, siendo posible obtener información energética sobre el efecto estabilizador o desestabilizador que produce la unión de un ligando. Entre los sistemas (proteínas) en los que está involucrado nuestro grupo de investigación está la glutatión S-transferasa, dUTPasa y lectinas como Concanavalina A, PNA y Galectina.
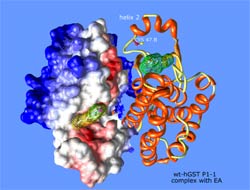
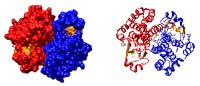
Las Glutation S-transferasas son enzimas diméricas, formadas por subunidades de 25 kDa aproximadamente. A su vez, cada una de estas subunidades está formada por dos dominios diferenciados: uno N-terminal y otro C-terminal, éste último de carácter alfa-helicoidal, contando cada subunidad, también, con al menos dos sitios de unión: uno para el sustrato GSH y otro sitio para el sustrato electrofílico.
La Glutation S-transferasa humana (hGSTP1-1) forma parte de una familia de enzimas diméricas multifuncionales presentes en la mayoría de las formas de vida, y pertenecientes a la Fase II del metabolismo de citotóxicos. La función desempeñada por estas enzimas se engloba dentro los procesos de desintoxicación intracelular de sustancias químicas nocivas, catalizando el ataque nucleofílico del átomo de azufre del sustrato GSH sobre el grupo electrofílico de un segundo sustrato (fisiológico o xenobiótico), y formando conjugados del glutatión, de mayor solubilidad en medio acuoso, lo que facilita su excreción fuera de la célula. Sin embargo, la función desintoxicante de esta enzima en ocasiones desempeña un efecto adverso durante la quimioterapia, ya que la GST también ha sido asociada con efectos de resistencia a fármacos por parte de las células tumorales. De hecho, se ha encontrado que ciertas formas de GST se expresan en grandes niveles en células tumorales de mamíferos, por lo que el nivel de expresión de la GST y sus propiedades bioquímicas son factores cruciales para la determinación de la resistencia celular a carcinógenos, drogas antitumorales, tóxicos ambientales y productos del estrés oxidativo celular.
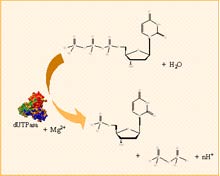
La enzima desoxiuridin 5’-trifosfato nucleótido-hidrolasa (dUTPasa, E.C. 3.6.1.23) cataliza la hidrólisis del enlace α--pirofosfato del dUTP para proporcionar dUMP y pirofosfato inorgánico, utilizando Mg2+ como cofactor. Esta enzima juega un papel determinante para la integridad del ADN en la división celular, previniendo la acumulación de dUTP y asegurando, a la vez, la provisión de dUMP, sustrato de la timidilato sintasa en la biosíntesis del dTTP. Sin embargo, su interés científico va bastante más allá, pues la enzima dUTPasa viene siendo investigada como posible agente antimalárico en humanos (dUTPasa de Plasmodium falciparum), y en diversos estudios para el desarrollo de fármacos citostáticos anticancerígenos. La dUTPasa es una enzima presente en la mayoría de los seres vivos. Según su estructura cuaternaria, las dUTPasas conocidas pueden clasificarse en monoméricas, diméricas, o triméricas, siendo las dos últimas las más estudiadas.